- İyilik Peşinde Koş
- ANASAYFA
- BİZ KİMİZ?
-
NELER YAPIYORUZ?
- Destek Başvurusu
- Tıbbi Cihaz Destekleri
- Medikal Malzeme Destekleri
- "Yanındayız" Kutuları
- Kira Desteği
- Diğer Destekler
- Kırtasiye Destekleri
- Eğitim Bursu
- Taşıyıcılık Taraması
- Yenidoğan Taraması
- Nusinersen Sodyum Uygulama Merkezleri
- PGT
- TBMM Araştırma Komisyonu
- Ziyaret / Toplantılar
- Üyeliklerimiz
- Seminerler
- SMA Farkındalık Ayı
- Ben SMA Filmi
- Yayınlarımız
- Projeler
- NASIL DESTEK OLABİLİRSİNİZ?
-
SMA
Avexis, AVXS-101 adlı gen tedavisi için FDA onayına başvurduklarını duyurdu. Bu ilaç SMA hastalarında eksik olan veya bozulmuş olan SMN1 geninin yerine yenisini koyan bir tedavidir. Bu ilacın, SMA Tip 1 bebekleri için uygun olması beklenmektedir. Buna ilaveten, Avexis, bu ilacın intratekal yani omurilik sıvısından uygulamasını da denemelerde test etmektedir. İntratekal uygulama ise, daha büyük hastalarında (tip 2-3) bu tedaviye erişmesini sağlayacaktır. FDA önce bu başvurunun tamam olup olmadığını inceleyecek, bunun ardından FDA bu başvuruyu AVXS-101’in intravenöz olarak uygulandığında güvenli ve etkili olduğunu belirlemek için değerlendirecektir. Kesin kararın 2019 yılının ikinci yarısında verilmesi beklenmektedir. Bu ilaç tek dozdur. Tek seferde sağlıklı gen enjekte edilmekte ve hastanın SMN proteinin üretebilir hale gelmesini sağlamaktadır. Avexis’in FDA ve EMA’dan onay aldıktan sonra piyasaya çıkması durumunda dünyadaki tek SMA ilacı olan Spinraza için fiyatların düşmesi beklenmektedir.
Konu ile ilgili detaylı bilgi almak için;http://www.curesma.org/news/avexis-statement-fda-filing.html
HUMAN TRIALS OF AVEXIS AVXS-101 GENE THERAPY
|
The Name Of The Study |
Countries of Operation |
Number of Patients |
Manner of Application |
Latest Status |
|
STR1VE |
USA |
- 20 SMA type-1 patient
- less than 6 months |
IV injection |
records complete |
|
STR1VE-EU |
EUROPE |
- 30 SMA type-1 patient
- less than 6 months |
IV injection |
Registration continues. Italy and UK are included |
|
SPRINT |
WORLD
WIDE |
At least 27 patients whose symptoms were observed before 6 weeks
- SMN2 copy must be 2 or 3 |
IV injection |
It continues in the USA and Canada.
Australia is newly included. |
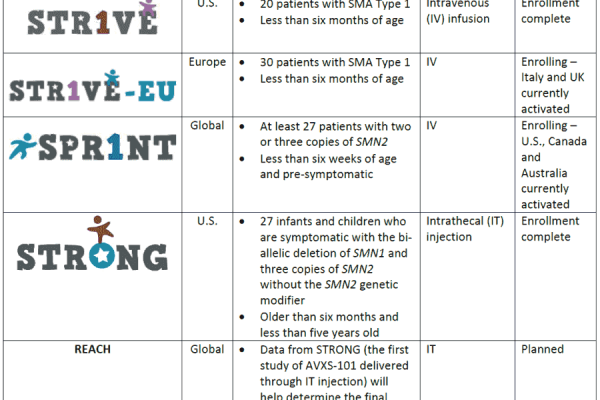
AVEXİS AVXS-101 GEN TEDAVİSİNİN İNSANLAR ÜZERİNDEKİ DENEMELERİ
| Çalışmanın Adı | Yürütüldüğü
Ülkeler |
Hasta Sayısı | Uygulama Şekli | Son Durum |
| STR1VE | A.B.D. | – 20 SMA tip-1 hastası
– 6 aydan küçük |
Damar yolu enjeksiyonu | Kayıtlar tamamlandı |
| STR1VE-EU | AVRUPA | – 30 SMA tip-1 hastası
– 6 aydan küçük |
Damar yolu enjeksiyonu | Kayıtlar devam ediyor. İtalya ve Ingiltere de dahil edildi |
| SPRINT | DÜNYA
GENELİ |
– Belirtileri 6 haftaliktan once gözlenen en az 27 hasta
– SMN2 kopyasi 2 veya 3 olmalı |
Damar yolu enjeksiyonu | A.B.D ve Kanada’da devam ediyor.
Avustralya yeni dahil edildi. |
| STRONG | A.B.D. | – SMN1 geni delesyona ugramış, gen modifikasyonuna ugramamiış 27 bebek ve cocuk.
– 6 aydan büyük ve 5 yaşından küçük olmalı – En az 3 SMN2 kopyası bulunmalı |
Omurilik enjeksiyonu | Kayıtlar tamamlandı |
| REACH | DÜNYA
GENELİ |
STRONG çalışmasından gelen bilgiler bu çalışmanın son haline karar verilmesine yardımcı olacak | Omurilik enjeksiyonu | Planlandı. |